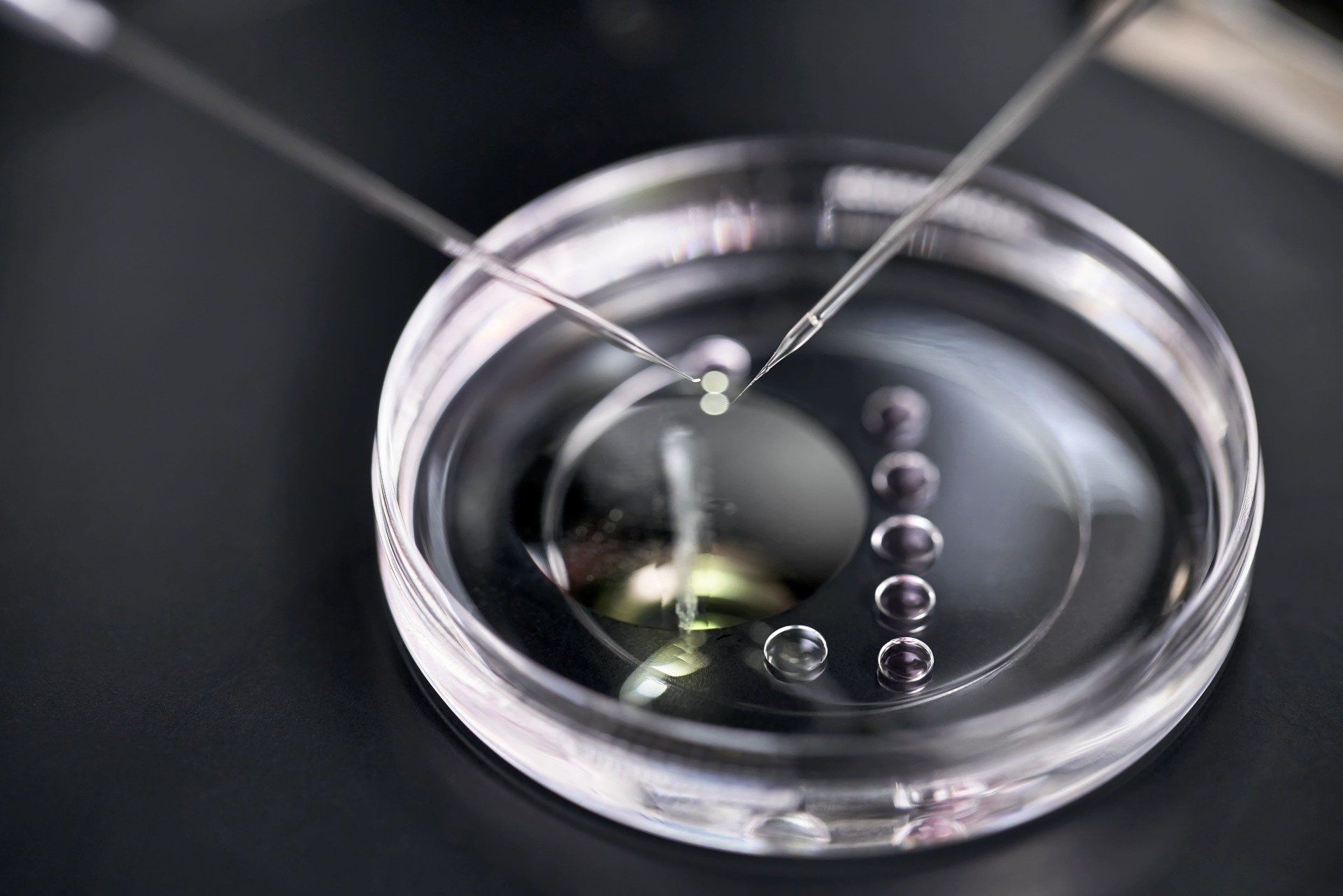
Diagnóstico Genético Pré-Implantacional
O Diagnóstico Genético Pré-Implantacional (PGD) é uma técnica avançada de reprodução assistida que permite a seleção de embriões livres de doenças genéticas antes da implantação no útero. Essa técnica é frequentemente utilizada por casais que têm um risco aumentado de transmitir doenças genéticas hereditárias aos seus descendentes. O PGD pode ser visto como uma extensão do diagnóstico genético pré-natal. O diagnóstico genético de gametas e embriões antes da implantação no útero, só foi possível após avanços na Fertilização in Vitro (FIV), principalmente em uma das etapas da FIV, a cultura prolongada dos embriões no laboratório.
O PGD, mais conhecido atualmente por PGT (teste genético pré-implantacional) é um procedimento tecnicamente desafiador, que exige um bom entendimento de embriologia e biologia molecular, mão de obra altamente especializada (embriologistas experientes) para a realização da biópsia embrionária e um laboratório terceirizado altamente qualificado para a realização da análise genética.
Como é feito o PGT (Teste Genético Pré-implantacional) ?
Para realizar a análise genético dos embriões é preciso realizar uma Fertilização In Vitro (FIV)
- Estimulação Ovariana: O processo de PGT geralmente começa com a estimulação ovariana da paciente para produzir múltiplos óvulos maduros.
- Fertilização In Vitro (FIV): Os óvulos são então coletados e fertilizados em laboratório através da Fertilização In Vitro (FIV), resultando em embriões.
- Biópsia de Embriões: Uma vez que os embriões atingem um estágio de desenvolvimento específico (tipicamente no estágio de blastocisto), é realizada a biópsia de embriões. Neste processo, são removidas uma ou algumas células do embrião para análise genética.
- Análise Genética: As células retiradas do embrião são analisadas para identificar a presença de mutações genéticas ou anormalidades cromossômicas.
- Seleção de Embriões Saudáveis: Com base nos resultados da análise genética, os embriões livres de doenças genéticas são selecionados para a transferência para o útero.
O papel da Biópsia de embriões no PGT
A biópsia de embriões é uma etapa crucial no processo de PGD. Ela permite a coleta de material genético dos embriões sem comprometer sua viabilidade, permitindo assim a seleção de embriões saudáveis para a transferência.
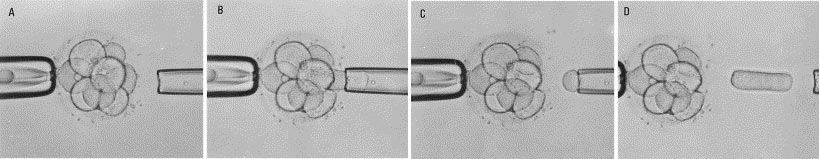
A biópsia de embriões é um procedimento técnico e delicado que é realizado em um laboratório de fertilização in vitro (FIV). O objetivo da biópsia é coletar células do embrião para realizar testes genéticos, como o PGT-A, PGT-M, ou PGT-SR. O processo envolve várias etapas cuidadosas para garantir que o material genético necessário seja obtido sem comprometer a viabilidade do embrião para o desenvolvimento futuro e implantação.
Etapas da Biópsia de Embriões
- Preparação do Embrião:
- O embrião é cultivado em laboratório até atingir o estágio adequado para a biópsia. Normalmente, isso ocorre no 5º dia após a fertilização, quando o embrião alcança o estágio de blastocisto.
- No estágio de blastocisto, o embrião tem cerca de 100 a 150 células e é composto por duas partes principais: o trofoectoderma (as células que eventualmente formam a placenta) e a massa celular interna (que desenvolverá no feto).
2. Imobilização do Embrião:
- O embrião é imobilizado sob um microscópio especial usando um dispositivo de fixação suave. Isso permite que o embriologista mantenha o embrião estável durante o procedimento.
3. Abertura da Zona Pelúcida:
- A zona pelúcida é a camada externa que envolve o embrião. Uma pequena abertura é feita na zona pelúcida usando um laser ou uma solução química ácida. Isso é necessário para acessar as células do trofoectoderma.
4. Coleta de Células:
- Utilizando ferramentas especializadas como uma pipeta de micromanipulação, cuidadosamente se aspiram várias células do trofoectoderma. Normalmente, cerca de 5 a 10 células são removidas, o que é suficiente para análise genética sem comprometer o desenvolvimento do embrião.
- A biópsia de células do trofoectoderma é preferida porque permite a obtenção de material genético sem perturbar a massa celular interna, que se desenvolverá no feto.
5. Análise Genética:
- As células coletadas são então enviadas para análise genética, onde serão testadas para várias condições genéticas usando técnicas como NGS ou PCR.
6. Congelamento do Embrião:
- Enquanto os resultados dos testes genéticos não estão prontos, o embrião é geralmente congelado (criopreservado). Isso permite que o laboratório tenha tempo suficiente para realizar a análise sem prejudicar as chances do embrião de implantar posteriormente.
Considerações
- Técnica Requerida: A biópsia de embriões exige habilidade técnica considerável e deve ser realizada por embriologistas experientes em um ambiente de laboratório bem equipado para minimizar os riscos de danos ao embrião.
- Riscos: Apesar da alta precisão e cuidado, a biópsia de embriões carrega um risco mínimo de danificar o embrião ou afetar adversamente seu potencial de implantação.
A biópsia de embriões é uma parte crucial do processo de diagnóstico genético pré-implantacional, possibilitando aos casais a oportunidade de aumentar as chances de ter um bebê saudável, especialmente quando há riscos conhecidos de doenças genéticas hereditárias.
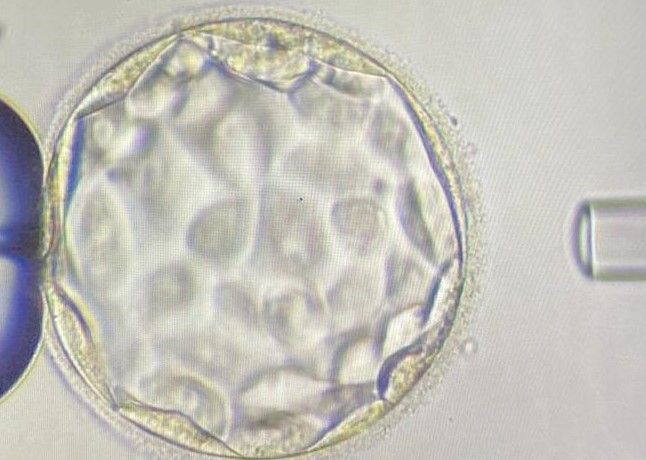
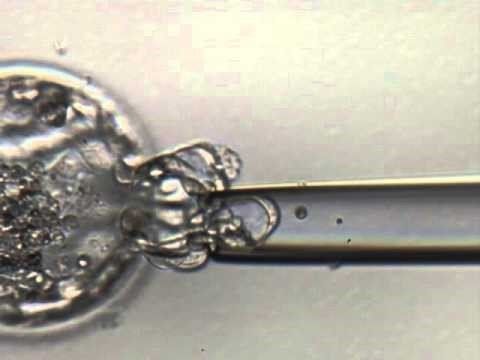
Indicações para o PGD
O PGD pode ser recomendado em casos de:
- Doenças genéticas hereditárias conhecidas na família
- Histórico de abortos recorrentes
- Idade materna avançada
- Falhas de implantação prévia em ciclos de FIV
- Histórico de anomalias cromossômicas em embriões anteriores
O Diagnóstico Genético Pré-Implantacional (PGD) com biópsia de embriões é uma ferramenta valiosa na medicina reprodutiva, permitindo que os casais tenham filhos saudáveis e reduzam o risco de transmitir doenças genéticas graves. Se você está considerando o PGD como parte do seu tratamento de fertilidade, é importante discutir suas opções com um especialista em reprodução assistida.
Técnicas laboratoriais para PGT
NGS
A técnica de análise por NGS (Next Generation Sequencing) é comumente empregada no PGT-a devido à sua alta precisão e capacidade de analisar múltiplos loci genéticos em paralelo.
Com a NGS, é possível examinar uma ampla gama de anormalidades cromossômicas em embriões, fornecendo uma visão mais abrangente e detalhada do perfil genético de cada embrião. Isso ajuda os especialistas em reprodução assistida a selecionar os embriões com maior potencial de resultar em gravidez bem-sucedida e saudável.
Além do PGT-a, para diagnóstico das Aneuploidias, dignóstico de alterações numéricas dos cromossomoos, existem outras formas de PGT, como o PGT-m (Pré-implantation Genetic Testing for Monogenic Disorders) e o PGT-SR (Pré-implantation Genetic Testing for Structural Rearrangements), que visam detectar doenças genéticas monogênicas específicas e rearranjos cromossômicos estruturais, respectivamente. Cada um desses testes tem suas próprias aplicações e técnicas de análise específicas.
Vantagens do NGS no PGT
1. Alta Precisão e Sensibilidade: O NGS pode detectar tanto variações numéricas cromossômicas (aneuploidias) como pequenas mutações genéticas. Isso o torna extremamente útil para aplicações como PGT-A (análise de aneuploidias), PGT-M (testes de doenças monogênicas), e PGT-SR (rearranjos cromossômicos estruturais).
2. Eficiência: O NGS permite o sequenciamento de muitas amostras ao mesmo tempo (sequenciamento em paralelo), o que economiza tempo e reduz custos, tornando o PGT mais acessível.
3. Flexibilidade: Esta tecnologia é capaz de identificar uma ampla gama de alterações genéticas, desde aneuploidias até variações de um único nucleotídeo (SNVs).
4. Análise Abrangente: O NGS pode fornecer informações detalhadas sobre o genoma do embrião, permitindo uma avaliação completa que ajuda a aumentar as taxas de sucesso da implantação e da gravidez.
Conheça os
Nossos Tratamentos
-
Inseminação Artificial
Saiba maisLorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua.
-
Fertilização In Vitro
Saiba maisLorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua.
-
Ovodoação
Saiba maisLorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua.
-
Congelamento de Óvulos
Saiba maisLorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua.
Clínica de Reprodução Humana em São Paulo
Consulta pré-agendada, presencial ou por telemedicina
Profissionais e equipamentos de ponta
Buscando proporcionar tratamentos seguros e de qualidade
Integralidade e Profissionalismo
Tratamentos baseado em ciência, acolhimento e profissionalismo
Agendamento de Consulta pelo WhatsApp
WhatsApp: (11) 95600-2313
Fale conosco
Formulário de Contato
Contact Us
Obrigado pela mensagem.
Nossa equipe entrará em contato em breve.
Parece que houve um erro.
Por favor, tente novamente.
Contato
Embryo Fetus & UNIRH
Avenida Brasil, 583
Jd. América – São Paulo – SP
Telefone: (11) 3051-2313
WhatsApp: (11) 95600-2313
Mapa do Site
Responsável Técnico: Dr. Vicente Ghilardi | CRM-SP: 79.654
Todos os direitos reservados. Desenvolvido por Future Marketing Médico.